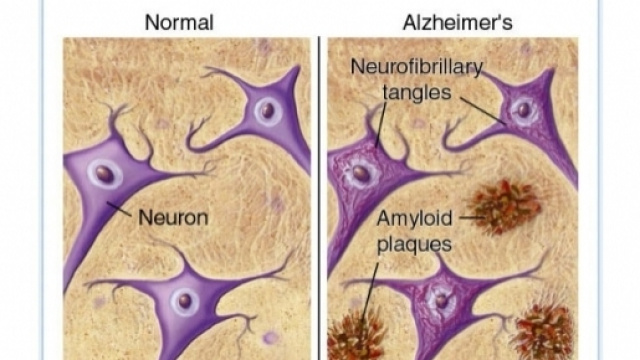
Almeno nelle fasi iniziali del morbo di alzheimer, un enzima presente nei neuroni è in grado di difendere i neuroni dagli effetti tossici delle placche di beta-amiloide, gli agglomerati proteici che si formano all'esterno dei neuroni e che progressivamente disattivano le connessioni sinaptiche.
L'enzima si chiama p38y, è una chinasi, ovvero un enzima che modula l'attività delle proteine aggiungendo molecole di fosfato organico alla loro struttura. Lo studio è stato pubblicato su Science da un gruppo di neuroscienziati australiani della South Wales University, ed è di fondamentale importanza per comprendere come il morbo di Alzheimer avanza oltre che per mettere a punto nuove armi per fermarlo.
Sinapsi, microtubuli e proteina tau
I neuroni comunicano tra di loro tramite il rilascio di neurotrasmettitori. Prima del rilascio a livello del terminale sinaptico, le molecole di neurotrasmettitore sono conservate all'interno di piccole sfere chiamate vescicole sinaptiche che, al momento opportuno, si fondono con la membrana cellulare liberando il loro contenuto.
La sintesi delle vescicole sinaptiche può avvenire anche a diversi centimetri di distanza dal luogo di rilascio. Le vescicole si muovono verso i terminali sinaptici sfruttando un sistema simile al trasporto del materiale in una vecchia miniera. Infatti, così come i vagoncini di una miniera scorrevano su binari metallici, le vescicole sinaptiche si muovono verso i terminali di rilascio su binari detti microtubuli, costituiti da catene proteiche di tubulina.
Affinché il trasporto delle vescicole verso le sinapsi sia efficiente, occorre che i microtubuli siano stabili ed elastici. Tale stabilità è garantita da una proteina detta tau che si avvolge attorno ai microtubuli rendendoli non solo resistenti, ma anche flessibili.
La proteina tau e le placche amiloidi
Il morbo di Alzheimer è caratterizzato dall'accumulo all'esterno dei neuroni della proteina beta-amiloide sotto forma di placche insolubili. Prima dello studio dei ricercatori australiani si pensava che le placche di beta-amiloide causassero l'instabilità e la disgregazione dei microtubuli tramite un processo di fosforilazione, ovvero di aggiunta di fosfato organico, della proteina tau che ne modifica le proprietà stabilizzanti.
La conseguenza è che i microtubuli cominciano a disgregarsi, la proteina tau si deposita nel neurone formando dei gomitoli o grovigli, il funzionamento delle sinapsi comincia a declinare dato che non ricevono più adeguate quantità di vescicole di neurotrasmettitore. Infine, il neurone muore perchè disconnesso dagli altri neuroni.
"Per comprendere meglio questo processo" spiega il professor Lars Ittner che ha guidato la ricerca "in questo studio abbiamo utilizzato campioni di tessuto nervoso umano della Sydney Brain Bank".
"Con nostra grande sorpresa" continua a spiegare il professor Ittner "abbiamo scoperto che nelle fasi iniziali del morbo di Alzheimer, il processo di fosforilazione della proteina tau ha un ruolo protettivo.
In particolare, attraverso l'attività dell'enzima p38γ, la proteina tau si protegge dagli attacchi delle placche beta-amiloidi e, di conseguenza, mantiene stabili i microtubuli su cui viaggiano le vescicole".
Durante la progressione del morbo, l'attività protettiva dell'enzima p38γ diminuisce fino a spegnersi. A quel punto i processi neurodegenerativi hanno la meglio e il tessuto nervoso si disgrega e si hanno le gravi conseguenze cognitive che caratterizzano l'Alzheimer.
"La buona notizia" conclude il professor Ittner "è che la reintroduzione dell'enzima p38γ, in topi affetti da Alzheimer in uno stadio avanzato, riattiva i suoi effetti protettivi sulla proteina tau e sui microtubuli, sui neuroni e sulle sinapsi riducendo i deficit cognitivi associati". Lo studio rappresenta una svolta nella comprensione dei meccanismi alla base del morbo di Alzheimer ed è una pietra miliare sulla strada verso una terapia efficace.