Dopo i risultati di uno studio clinico di Fase III, condotto in 41 centri - situati negli Stati Uniti, in Canada, in Europa e in Giordania - a dicembre 2018 l’anticorpo lanadelumab era stato approvato dalla Commissione Europea (CE). Ora, dopo l’approvazione di AIFA, questo farmaco è disponibile anche in Italia. L’angioedema ereditario è una malattia rara, genetica, caratterizzata dallo sviluppo di gonfiori (edema) che colpiscono la cute, le mucose e gli organi interni. In alcuni casi, se coinvolge l’apparato respiratorio, può essere anche letale.
Oggi è la giornata mondiale dell'Angioedema
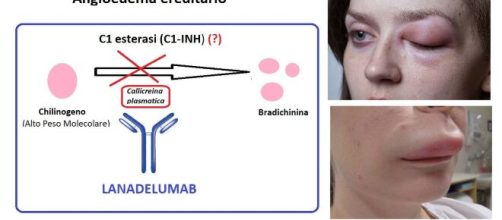
Gli hanno addirittura dedicata una giornata a questa malattia, il 16 maggio: giornata mondiale dell’Angioedema ereditario, una malattia causata dalla disfunzione o mancanza di un enzima, l’inibitore di C1 esterasi (C1-INH). Si tratta di un inibitore delle proteasi seriniche (SERPIN, SERum Potease INhibitors) che blocca alcune componenti della cascata della coagulazione e la callicreina, una proteina che regola il sistema immunitario ed è coinvolta nei meccanismi della coagulazione del sangue. Un deficit di C1-INH determina un innalzamento dei livelli di bradichinina, un'altra proteina ad attività pro-infiammatoria, potente vasodilatatore, che attiva dei meccanismi che portano alla comparsa di gonfiore (edema), arrossamento, calore e a volte anche dolore: tutti sintomi che affliggono i pazienti con Angioedema ereditario.
È una malattia genetica rara con una incidenza di un caso ogni 8mila-50mila persone in tutto il mondo. A causa della sua rarità, è poco conosciuta e spesso non viene diagnosticata correttamente. In alcuni casi, un ritardo della diagnosi può risultare anche fatale.
Finora le uniche terapie disponibili per il controllo di questa patologia erano gli androgeni orali e i concentrati di C1-INH, che comunque avevano importanti effetti collaterali.
Un anticorpo monoclonale umano IgG1, lanadelumab (nome commerciale Takhzyro), sviluppato da Shire, ora gruppo Takeda, ha avuto l’approvazione prima negli Stati Uniti, poi in Europa, per la prevenzione degli attacchi ricorrenti di angioedema nei pazienti con questa malattia. Il farmaco viene somministrato sottocute, due volte al mese, con una riduzione dell’87% delle recidive.
Le prove cliniche
Uno studio clinico di Fase III, condotto in 41 centri, tra Stati Uniti, in Canada, in Europa e in Giordania, pubblicato a novembre 2018 su Journal of the American Medical Association (JAMA), primo autore Aleena Banerji, riportava i risultati ottenuti su 125 partecipanti. Lo studio, in doppio cieco e randomizzato, aveva suddiviso i partecipanti in quattro gruppi, tre avevano ricevuto dosaggi differenti di lanadelumab (150 mg/4 settimane, 300 mg/4 settimane, 300 mg/2 settimane) per 26 settimane. Un quarto era il gruppo placebo.
Tutti i dosaggi avevano ridotto il numero di attacchi di edema, in confronto al placebo. Molti pazienti, che avevano preso il farmaco, nel periodo in esame non avevano manifestato attacchi (44%) rispetto al gruppo placebo (2,4%).
Ma, andando a considerare solo le ultime 16 settimane di trattamento, il 77% dei pazienti in trattamento non ha avuto attacchi, rispetto al 3% dei pazienti del gruppo placebo. Sul fronte della qualità di vita, i pazienti trattati con lanadelumab avevano riscontrato un miglioramento in termini di minor affaticamento, paura, vergogna rispetto al gruppo placebo.
Questi risultati rappresentano una speranza per chi soffre di questa malattia genetica che, oltre ad essere rara, ha lo svantaggio di essere poco conosciuta ed è spesso non diagnosticata correttamente, e finora senza dei farmaci specifici, ben tollerati.